ArtÃculo Original
Vasculitis asociadas a ANCA: análisis de 26 pacientes
Pablo Young, Nicolás MarÃn Zúcaro, AgustÃn Montes OnganÃa, Franco Giuliani Manzano, MarÃa Victoria Faura, MarÃa Agustina Bustos, Amalia Schiel, Alexis Muryan, Débora Pellegrini, Geoffrey Earsman, Hugo A Laborde, Bárbara C Finn, Julio E Bruetman, Hernán Trimarchi, Alejandro Iotti, MartÃn Bosio, Damián Duartes Noe
Revista Fronteras en Medicina 2022;(03): 0164-0170 | DOI: 10.31954/RFEM/202203/0164-0170
Las vasculitis asociadas a anticuerpos anticitoplasma de neutrófilos (ANCA) comprenden un subgrupo de afección de pequeños vasos que comparten en forma variable la presencia de ANCA. Se analizaron todos los pacientes con vasculitis asociadas a ANCA que fueron atendidos en el Hospital Británico de Buenos Aires durante los años 2000 a 2016 con el objetivo de describir la casuística de nuestro centro.
Se incorporaron un total de 26 pacientes: 11 (42.31%) granulomatosis con poliangeítis (GPA), 6 (23.08%) poliangeítis microscópica (MPA) y vasculitis limitada al riñón (VLR) y 3 (11.54%) granulomatosis eosinofílica con poliangeítis (EGPA). La edad media al diagnóstico fue de 51.73±18.85 años (18-78) con predominio de sexo femenino (57.61%).
El compromiso inicial más frecuente fue renal (73.08%), seguido por compromiso pulmonar (42.31%) y rinosinusal (26.92%). Cinco pacientes (19.23%) debutaron con síndrome pulmón-riñón y 6 (23.08%) presentaron afectación de más de dos órganos al inicio. La clasificación clínica más común fue la generalizada (34.62%), seguido por la severa (30.77%), con una media de BVAS de 16.6. El 92.31% presentaron determinaciones de ANCA positivas y 76.92% biopsia diagnóstica positiva.
Los 26 pacientes realizaron tratamiento de inducción, la adición de ciclofosfamida a glucocorticoides fue la terapia dual más frecuente. En forma global el 50% de los pacientes que ingresaron al estudio lograron remisión, el 61.53% luego de la inducción inicial y el resto luego del tratamiento de la recaída. La mortalidad global fue de 15.38%, ocurriendo durante la inducción inicial, no reportándose eventos durante la remisión o recaída.
Del análisis de nuestra serie se desprende que a pesar del compromiso clínico severo es posible reducir la mortalidad con los nuevos esquemas de tratamiento.
Palabras clave: vasculitis asociadas a ANCA, granulomatosis con poliangeÃtis, poliangeÃtis microscópica, vasculitis limitada al riñón, granulomatosis eosinofÃlica con poliangeÃtis.
Antineutrophil cytoplasmic antibody (ANCA)-associated vasculitides comprise a subgroup of small-vessel disease that variably share the presence of ANCA. All patients with ANCA-associated vasculitis who were treated at the British Hospital in Buenos Aires during the years 2000 to 2016 were analyzed with the aim of describing the casuistry of our center.
A total of 26 patients were included: 11 (42.31%) had granulomatosis with polyangiitis (GPA), 6 (23.08%) had microscopic polyangiitis (MPA) and vasculitis limited to the kidney (VLR) and 3 (11.54%) presented eosinophilic granulomatosis with polyangiitis (EGPA). The mean age at diagnosis was 51.73 ± 18.85 years (18-78) with a predominance of females (57.61%).
The most frequent initial compromise was renal (73.08%), followed by pulmonary (42.31%) and rhinosinusal (26.92%) involvement. Five patients (19.23%) begin with lung-kidney syndrome and 6 (23.08%) presented with involvement of more than two organs at the outset. The most common clinical classification was generalized (34.62%), followed by severe (30.77%), with a mean BVAS of 16.6. 92.31% presented with positive ANCA determinations and 76.92% with a positive diagnostic biopsy.
The 26 patients underwent induction treatment, the addition of cyclophosphamide to glucocorticoids being the most frequent dual therapy. Overall, 50% of the patients who entered the study achieved remission, 61.53% after the initial induction and the rest after relapse treatment. Overall mortality was 15.38%, these during the initial induction, with no events reported during remission or relapse.
From the analysis of our series, it can be inferred that despite the severe clinical compromise, it is possible to reduce mortality with the new treatment schemes.
Keywords: ANCA-associated vasculitis, granulomatosis with polyangiitis, microscopic polyangiitis, vasculitis limited to the kidney, eosinophilic granulomatosis with polyangiitis.
Los autores declaran no poseer conflictos de intereses.
Fuente de información Hospital Británico de Buenos Aires. Para solicitudes de reimpresión a Revista Fronteras en Medicina hacer click aquí.
Recibido 2022-08-22 | Aceptado 2022-09-30 | Publicado 2022-09-30
Esta revista tiene libre acceso a descargar los artículos sin costo (Open Acces), además se encuentra indizada en Latindex y LILACS (BVS.org) y en proceso de incorporación en el núcleo básico de revistas del CONICET.

Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial-SinDerivar 4.0 Internacional.
Introducción
El término vasculitis engloba un heterogéneo grupo de procesos clínicos con un sustrato patológico común: inflamación y necrosis de los vasos sanguíneos, con lesión de la íntima y en ocasiones formación de granulomas perivasculares o extravasculares.
En el año 2012, en la segunda Conferencia Consenso Internacional en Chapel Hill, se establece un cambio en la nomenclatura y en la clasificación, reconociendo subdivisiones en función del calibre del vaso afectado, el evento fisiopatológico subyacente o la etiología secundaria1.
En función del tamaño del vaso afectado se clasifican en vasculitis de grandes, medianos y pequeños vasos1.
Dentro de las vasculitis de pequeños vasos, se reconocen dos entidades con fisiopatologías diferentes, aquellas en las cuales el daño vascular se debe a la presencia de complejos inmunes y aquellas secundarias a la presencia de anticuerpos anticitoplasma de neutrófilos (ANCA).
Las vasculitis asociadas a ANCA comprenden la granulomatosis con poliangeítis (GPA, previamente conocida como granulomatosis de Wegener), la poliangeítis microscópica (MPA), la granulomatosis con poliangeítis eosinofílica (EGPA, previamente conocida como enfermedad de Churg-Strauss) y la vasculitis limitada al riñón o glomerulonefritis necrosante semilunar1-4.
Los anticuerpos anticitoplasma de neutrófilos están dirigidos contra proteínas de los gránulos citoplasmáticos de los neutrófilos y monocitos. Existen dos categorías principales de ANCA según los objetivos de los anticuerpos. El término ANCA citoplasmático (c-ANCA) se refiere al patrón difuso y granular con el que se tiñe el citoplasma bajo el microscopio inmunofluorescente, siendo el antígeno la proteinasa 3. Más del 90% de los pacientes con GPA poseen anticuerpos identificables contra la proteinasa 3. El término ANCA perinuclear (p-ANCA) se refiere al patrón de tinción perinuclear o nuclear más circunscrito de los neutrófilos indicadores. El objetivo principal de p-ANCA es la enzima mieloperoxidasa. Este grupo de entidades se considera la forma más común de vasculitis sistémica primaria de pequeños vasos en adultos1,5,6.
La incidencia anual global de las vasculitis asociadas a ANCA es de 20 casos por millón de habitantes, siendo de entre 2.1 a 15 en GPA, 2.1 a 17.5 en MPA y 0.5 a 3.1 en EGPA, mostrando variaciones geográficas e interétnicas. El pico de incidencia de las mismas se observa en el grupo etario de 55 a 74 años7-17.
El objetivo de nuestro estudio es describir la casuística de vasculitis asociadas a ANCA en nuestro centro por medio de la determinación de características clínicas, analíticas, epidemiológicas y su evolución y pronóstico luego del tratamiento.
Materiales y métodos
Se incorporaron todos los pacientes con vasculitis asociadas a ANCA que fueron atendidos en el Hospital Británico de Buenos Aires durante los años 2000 a 2016. Para el diagnóstico se utilizaron elementos clínicos y anatomopatológicos, así como criterios clasificatorios propuestos por el American College of Rheumatology (ACR) y la Segunda Conferencia de Consenso de Chapel Hill junto con las recomendaciones del Grupo European League Against Rheumatism (EULAR).
Los pacientes se reclutaron en base a tres estrategias de búsqueda. Se accedió mediante las palabras claves “vasculitis y/o angeítis y glomerulonefritis extracapilar” en la descripción anatomopatológica. Se buscaron las mismas palabras por ICD9 o GRD. Además, se incorporó en la búsqueda a pacientes ANCA positivos mediante el registro de laboratorio.
Se analizaron las historias clínicas que cumplieron criterios de inclusión a fin de identificar las características clínicas, demográficas, epidemiológicas, así como para evaluar la clasificación de la severidad de la enfermedad, el grado de actividad, el órgano comprometido al inicio y durante el seguimiento, el tratamiento instaurado y la posterior respuesta al mismo.
Se incorporaron variables de laboratorio como: hematocrito, hemoglobina, eritrosedimentación, proteína C reactiva, creatinina y clearance de creatinina (mediante MDRD). Las determinaciones de ANCA se realizaron mediante técnicas de inmunofluorescencia indirecta (IFI).
La estratificación de la enfermedad se realizó mediante el score del European Vasculitis Study Group (EUVAS) y la actividad de la enfermedad mediante el score de Birmingham Vasculitis Activity Score (BVAS).
Se definió como respuesta al tratamiento a una reducción mayor o igual al 50% en la actividad de la enfermedad, evaluada por BVAS. Se consideró remisión de enfermedad a la ausencia completa de actividad de la patología, incluyendo no solo las manifestaciones vasculíticas sino también las granulomatosas, por al menos tres meses con una dosis máxima de glucocorticoides de 10 mg/día de prednisona o su equivalente. Se consideró recaída a la recurrencia o nueva aparición de actividad atribuible a inflamación activa. Los pacientes que no respondieron a la terapéutica inicial fueron considerados como refractarios.
Resultados
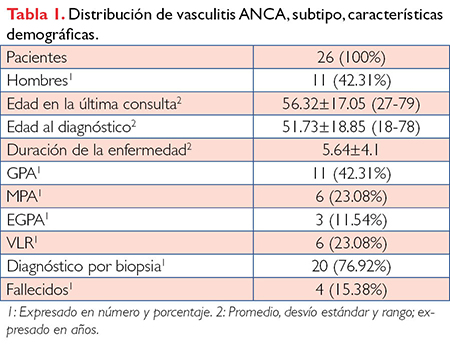
Se incluyeron en total 26 pacientes de 68 potenciales con diagnóstico de vasculitis asociadas a ANCA, 15 mujeres (57.69%) y 11 hombres (42.31%), con una edad promedio en la última consulta de 56.32±17.05 años (rango de 27 a 79 años). La edad promedio al diagnóstico fue de 51.73±18.85 años (rango de 18 a 78 años) y presentaron una duración media de la enfermedad de 5.64 ± 4.1 años. Al finalizar el estudio, 4 pacientes (15.38%) habían fallecido.
Como puede apreciarse en la Tabla 1, la vasculitis ANCA más prevalente fue la GPA con 11 pacientes (42.31%), seguido de VLR y MPA con 6 (23.08%) y la EGPA con 3 (11.54%). El diagnóstico por biopsia se realizó en 20 pacientes (76.92%).
Con respecto a las características de laboratorio, la anemia fue el hallazgo más común, 21 pacientes (80.77%), seguido por eritrosedimentación elevada e injuria renal aguda con 16 (61.54%) y 14 (53.85%), respectivamente.
El 92.31% de los pacientes fueron ANCA positivos, de los anteriores 10 (41.67%) c-ANCA y 14 (58.33%) p-ANCA. Sólo dos pacientes fueron ANCA negativos, correspondientes a una GPA y a una EGPA (Tabla 2).
El compromiso inicial más frecuente fue el renal con 19 pacientes (73.08%), seguido por el pulmonar con 11 (42.31%) y el rinosinusal con 7 (26.92%). Cinco pacientes (19.23%) debutaron con síndrome pulmón-riñón y 6 (23.08%) presentaron afectación de más de dos órganos al inicio. El 70% de las GPA presentaron compromiso pulmonar y el 60% renal, mientras que de las MPA el 100% presentaron daño renal y el 50% pulmonar (Tabla 3).
De los 19 pacientes con compromiso renal, 15 (78.95%) se manifestaron como injuria renal aguda, 13 (68.42%) desarrollaron proteinuria y 12 (63.16%) microhematuria.
De los 11 pacientes que presentaron al inicio compromiso pulmonar, 6 (54.55%) desarrollaron hemorragia alveolar y 5 (45.45%) nódulos pulmonares. El 85.71% de los pacientes que presentaron afectación otorrinolaringológica tuvieron compromiso rinosinusal y 14.29%, hipoacusia.
Durante la evolución de la enfermedad no se registró actividad renal en los pacientes que no la habían desarrollado en la forma inicial. Por otro lado 4 pacientes adicionaron compromiso pulmonar, 2 en forma de hemorragia alveolar y 2 en forma de nódulos pulmonares, de ellos 2 GPA y 2 MPA (Tabla 4).
Según el score de EUVAS, la clasificación clínica más común fue la generalizada con 9 pacientes (34.62%), seguida en frecuencia por la severa, con 8 pacientes (30.77%). La mitad de los casos severos correspondieron a MPA. La media de actividad medida por BVAS fue de 16.6 (Tabla 5).
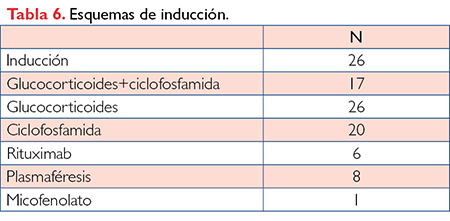
Los 26 pacientes realizaron tratamiento de inducción. El 100% recibió glucocorticoides, 18 (69.23%) en forma de pulsos endovenosos y 20 (76.92%) adicionaron ciclofosfamida al tratamiento, siendo esta la terapia dual más frecuente. Diez pacientes (50%) realizaron ciclofosfamida endovenosa y 10 (50%) vía oral. El 30.76% de los pacientes utilizaron plasmaféresis y el 19.23% rituximab. Cuatro pacientes combinaron plasmaféresis con rituximab, todos en caso de EUVAS severo con compromiso renal y/o pulmonar (Tabla 6).
Luego de la inducción, 16 pacientes (61.54%) lograron la remisión de la enfermedad, teniendo mejores respuestas las GPA y MPA en comparación con el resto (Tabla 7).
De los 18 pacientes con afectación renal, el 61.11% requirió diálisis aguda durante la inducción, 7 (38.89%) diálisis crónica, de estos últimos, el 42.87% realizó trasplante renal; 4 pacientes (18.18%) fallecieron luego de la inducción, 3 de estos por actividad de la enfermedad y uno por complicaciones infecciosas.
Veintidós pacientes recibieron terapia de mantenimiento, 16 de los cuales habían logrado remisión; entre estos, el 100% utilizó glucocorticoides vía oral, y el ahorrador de esteroides más frecuente fue la ciclofosfamida. La mitad de los pacientes que ingresaron en remisión tras el mantenimiento experimentaron recaída de la enfermedad en tiempo variable. La recaída más frecuente fue la pulmonar y la rinosinusal; solo dos pacientes presentaron recaída renal. El 62.5% de los pacientes que recayeron utilizaron rituximab de rescate logrando la remisión en el 60% de los casos.
En forma global, el 50% de los pacientes que ingresaron al estudio lograron la remisión, el 61.53% luego de la inducción inicial y el resto luego del tratamiento de la recaída.
La mortalidad global fue del 15.38%, ocurriendo la misma durante la inducción inicial, no reportándose eventos durante la remisión o recaída.
Discusión
Se presentó una serie de 26 pacientes con diagnóstico de vasculitis asociadas a ANCA. La vasculitis más frecuente fue la GPA concordante con la literatura, seguida por la MPA y la VLR1-7. Se observó menor prevalencia de MPA de lo reportado en series americanas y europeas, con un porcentaje intermedio con respecto a los estudios publicados en Argentina18-22. La distribución de EGPA fue similar, siendo la vasculitis ANCA menos frecuente18-22.
La edad al diagnóstico de las series publicadas varía en función de la región y la distribución de los subtipos de vasculitis ANCA, aunque con un rango de edad medio de 55 a 74 años, a excepción de la EGPA en el cual el rango de edad desciende aproximadamente 10 años6. La edad promedio al diagnóstico en nuestra serie fue de 3 años menor a lo reportado en estudios europeos pero similar a lo publicado en Argentina6-22. En el subanálisis de edad por subtipo de vasculitis no hubo diferencias a lo reportado, a excepción de la EGPA con una edad promedio 10 años mayor al diagnóstico.
La distribución por género, si se considera el global de las vasculitis ANCA, fue similar a lo publicado en distintas series, a excepción de la GPA en donde el ratio se invierte con 64% de hombres afectados18-26.
Se ha demostrado cierta predisposición genética de HLA-DP para PR3 y HLA-DQ para MPO, lo que avala que son síndromes autoinmunes distintos y posiblemente gatillados por factores externos27,28.
Las manifestaciones clínicas son variadas, pudiendo limitarse solo al riñón o comprometer la vía aérea superior, los pulmones, la piel entre otros órganos29-37. El compromiso renal ocurre en el 70% de los pacientes y se suele manifestar como una glomerulonefritis rápidamente progresiva, pudiendo evolucionar en el 50-66% de los casos a insuficiencia renal crónica con un grado variable de ingreso a hemodiálisis crónica. El compromiso pulmonar se observa en aproximadamente la mitad de los pacientes y puede variar desde cuadros clínicos con infiltrados pulmonares o nódulos hasta formas severas como fibrosis y hemorragia pulmonar8,31,38. Nuestro grupo ha publicado pacientes con formas de presentación infrecuentes33,34.
Las formas clínicas de inicio más frecuentes fueron las caracterizadas por compromiso renal, pulmonar y otorrinolaringológico, hecho que coincide con lo comunicado en la literatura8,25-41. Si bien el compromiso renal en forma global fue cercano al 70%, similar al de otras series, en el análisis de subgrupos evidenciamos menor compromiso a lo reportado en la GPA (54.54%) y mayor compromiso en la MPA (100%). La insuficiencia renal como manifestación inicial se observó en el 79% de los pacientes, requiriendo hemodiálisis en más de la mitad de los casos. Estas cifras son similares a las publicadas en Argentina y de mayor magnitud si se las compara con las europeas y americanas18,39-42; esto podría explicarse debido a la estrategia de búsqueda, en la cual se incorporaron en su mayoría, pacientes con requerimiento de internación, desviando la proporción hacia cuadros más severo. Lo anterior se ve reflejado en que la mitad de los pacientes con diálisis aguda requirieron continuar en forma crónica y más de la mitad de los anteriores fueron trasplantados por enfermedad refractaria43,44.
La proporción de afectación pulmón-riñón al inicio fue menor a lo comunicado, aunque durante el seguimiento las cifras fueron similares debido a las recaídas pulmonares de pacientes con compromiso renal31,45.
El compromiso pulmonar en la GPA fue del 54.54%, menor al reportado en la literatura, tanto en forma inicial como en el seguimiento39-45. En la MPA la frecuencia coincidió con el 30 a 50% de afectación reportada42-46. Clínicamente, la hemorragia alveolar fue la presentación más frecuente, siendo en la MPA del 33%, coincidente con lo publicado y en la GPA del 27%, cifra mayor a la comunicada47,48.
La presentación clínica inicial más común con respecto al compromiso del sistema nervioso periférico y al otorrinolaringológico fue la mononeuritis múltiple y la rinosinusitis respectivamente30,49. Se observó en comparación con la literatura menor compromiso oftalmológico y cutáneo, probablemente debido a la selección en su mayoría de pacientes internados, es decir formas más graves42. Es representación de lo antes mencionado el hecho de que solo 19% de los pacientes incluidos tuvieron una clasificación de EUVAS localizada o sistémica temprana. Con una media de BVAS por encima de lo reportado en otra serie Argentina20.
El estado de actividad define la condición clínica potencialmente reversible con tratamiento, motivo por el cual se cuenta con scores pronósticos que pueden diferenciar las manifestaciones clínicas debidas a la actividad de la enfermedad, así como aquellas secundarias al daño inducido por la misma patología o producidas por el tratamiento9.
El BVAS refleja actividad de la enfermedad sistémica en un momento dado y es útil para comparar el grado de actividad en pacientes bajo diferentes regímenes terapéuticos, así como para el seguimiento. Este método puntúa numéricamente los síntomas de 9 órganos o sistemas y valores de laboratorio, pudiendo obtener una puntuación máxima de 56 puntos10-12. Se considera respuesta al tratamiento, una disminución del BVAS del 50% con respecto al basal13.
La proporción de positividad de ANCA fue elevada, siendo negativos solo el 8% de los pacientes incluidos, hecho relacionado en parte con la mayor frecuencia en nuestra serie de GPA y por otro lado asociado a la estrategia de búsqueda.
La totalidad de los pacientes con afectación renal tuvieron biopsia orientativa hacia el subtipo de vasculitis, así como dos pacientes con compromiso ORL.
En este último año, luego de un importante trabajo de colaboración entre la American College of Rheumatology y la European Alliance of Associations for Rheumatology, han surgido los nuevos criterios clasificatorios para las vasculitis asociadas a ANCA29,50-52.
Se siguen estudiando biomarcadores con el objetivo de encontrar moléculas marcadoras genéricas de inflamación o títulos de ANCA que puedan reflejar fuertemente la actividad de la enfermedad o predecir futuros brotes en vasculitis asociadas a ANCA, lo que sigue siendo difícil de alcanzar53-63. Entre ellos, algunos prometedores son los niveles séricos de proteosoma 20S, el CD163 soluble en orina, el suPAR, pentraxina-3 y algunos más tradicionales que están mostrando alguna utilidad, como el índice de masa corporal y el ratio eritrosedimentación/PCR, entre otros55-63.
Desde la introducción de la ciclofosfamida y las altas dosis de corticoides, las vasculitis asociadas a ANCA se han transformado de una enfermedad que de 90% de mortalidad al año pasó a ser una enfermedad crónica con remisiones y recaídas29,64-66. Actualmente la mortalidad a 5 años es del 25% y la tasa de recaída del 50%. El tratamiento de inducción con ciclofosfamida y altas dosis de corticoides constituye la elección habitual en pacientes con enfermedad severa, considerando otras alternativas para enfermedades que no comprometan la vida. Azatioprina, micofenolato y metotrexato, junto con bajas dosis de corticoides, son principalmente utilizados para la terapia de mantenimiento14. La plasmaféresis asociada a la inmunosupresión se reserva para casos de gravedad, ya que demostró mejorar el compromiso renal. El uso de agentes biológicos como el rituximab surge como nueva terapia de tratamiento tanto para la fase de inducción o recaída, como para el mantenimiento de la enfermedad15-17. Desde el año 2010 es una opción en inducción o mantenimiento cada vez más atractiva debido a su perfil de seguridad29,64-69.
El tratamiento de inducción más común fue la combinación de corticoides en forma de pulsos asociados a ciclofosfamida endovenosa, debido en parte al compromiso clínico de la enfermedad, hecho que coincide con reportes argentinos18. La tasa de remisión inducida por este esquema fue del 50%, que es menor a la reportada, estimada en el seguimiento en 75%45,67,68. En cuanto a los corticoides en inducción se están reevaluando las dosis óptimas extrapolando lo que ocurre en el lupus eritematoso sistémico. Algunos trabajos recientes hablan de no dar dosis mayores de 30 mg en promedio y que estas serían similares a las de 60 mg (por un mecanismo de saturación de receptores) y con menos efectos adversos70-72.
Al igual que en la literatura, la indicación de plasmaféresis adicional al tratamiento de inducción fue en los casos de EUVAS severo o generalizado con compromiso renal73-75. Dos metaanálisis recientes mostraron que la plasmaféresis no cambió la mortalidad en esta enfermedad, pero sí disminuyó la progresión a enfermedad renal crónica, si bien a costa de un incremento importante de las infecciones76,77.
En las recaídas luego del tratamiento estándar, el rituximab fue el agente más utilizado con grados de remisión variable. En pacientes refractarios a esta droga están apareciendo nuevas posibilidades78.
El avacopan es un nuevo inhibidor competitivo oral de C5aR (factor de complemento). Datos recientes obtenidos en modelos animales y en humanos confirmaron su eficacia y seguridad en pacientes con vasculitis asociadas a ANCA, permitiendo un régimen libre de esteroides79-81.
La tasa de remisión de los pacientes con GPA fue mayor al 50% reportado, mientras que en la MPA fue similar al 70%39.
Aunque en nuestra serie predominaron cuadros graves de compromiso clínico, la mortalidad se situó en un valor intermedio del 8 al 20%42.
Es de destacar que sumado al daño que produce la enfermedad, la actividad inflamatoria se asocia con un alto riesgo de ciertos tipos de eventos cardiovasculares como sucede en múltiples enfermedades reumatológicas82.
El avance en los métodos de diagnóstico y tratamiento permitió el cambio del espectro de una enfermedad con alta mortalidad a una patología con alta morbilidad. Del análisis de nuestra serie se desprende que a pesar del compromiso clínico severo es posible reducir la mortalidad con los nuevos esquemas de tratamiento.
-
Jennette JC, Falk RJ, Bacon PA, et al. 2012 Revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum 2013; 65:1-11.
-
Young P. A propósito de la enfermedad de Wegener y los epónimos en medicina. RAMR 2015;1:14-7.
-
Young P, Finn BC, Bruetman JE. ¿Se debería seguir llamando enfermedad de Wegener? Medicina (B Aires) 2009;69(2):291-2.
-
Young P. Granulomatosis con poliangeítis. Medicina (B Aires) 2014;74(3):262.
-
Watts RA, Carruthers DM, Scott DG. Epidemiology of systemic vasculitis. Changing incidence or definition. Semin Arthritis Rheum 1995;25:28-34.
-
Watts RA, Lane SE, Bentham G, Scott DG. Epidemiology of systemic vasculitis. A ten-year study in the United Kingdom. Arthritis Rheum 2000;43:414-9.
-
Gibelin A, Maldini C, Mahr A. Epidemiology and etiology of Wegener granulomatosis, microscopic polyangiitis, Churg-Strauss syndrome and Goodpasture syndrome: vasculitides with frequent lung involvement. Semin Respir Crit Care Med 2011;32:264-73.
-
Seo P, Stone JH. The antineutrophil cytoplasmic antibody-associated vasculitides. Am J Med 2004;117:39-50.
-
The American College of Rheumatology-1990 criteria for the classification of vasculitis. Arthritis Rheum 1990:33:1065-1136.
-
Luqmani RA, Bacon PA, Moots RJ, et al. Birmingham Vasculitis Activity Score (BVAS) in systemic necrotizing vasculitis. QJM 1994;87:671-8.
-
Luqmani RA, Exley AR, Kitas GD, Bacon PA. Disease assessment and management of the vasculitides. Baillieres Clin Rheumatol 1997;11:423-46.
-
Mukhtyar C, Lee R, Brown D, et al. Modification and validation of the Birmingham Vasculitis Activity Score (version 3). Ann Rheum Dis 2009;68:1827-32.
-
Hellmich B, Flossmann O, Gross WL, et al. EULAR recommendations for conducting clinical studies and/or clinical trials in systemic vasculitis: focus on anti-neutrophil cytoplasm antibody associated vasculitis. Ann Rheum Dis 2007;66:605-17.
-
Jayne D, Rasmussen N, Andrassy K, et al. European Vasculitis Study Group: A randomized trial of maintenance therapy for vasculitis associated with antineutrophil cytoplasmic autoantibodies. N Engl J Med 2003;349:36-44.
-
Jones RB, Tervaert JW, Hauser T, et al. Rituximab versus cyclophosphamide in ANCA-associated renal vasculitis. N Engl J Med 2010;363:211-20.
-
Stone JH, Merkel PA, Spiera R, et al. Rituximab versus cyclophosphamide for ANCA-associated vasculitis. N Engl J Med 2010;363:221-32.
-
Yates M, Watts RA, Bajema IM, et al. EULAR/ERA-EDTA recommendations for the management of ANCA-associated vasculitis. Ann Rheum Dis 2016;75:1583-94.
-
Paolini M, Ruffino JP, Fernández Romero DS. Vasculitis asociada a anticuerpos anti-citoplasma de neutrófilos clínica y tratamiento. Medicina (Bs Aires) 2013;73:119-26.
-
Scaglioni V, Scolnik M, Marin J, et al. Vasculitis de pequeños vasos asociadas a anticuerpos anti citoplasma de neutrófilos. Estudio clínico y de sobrevida de una cohorte de 84 pacientes seguida en un único centro. En: https://www.hospitalitaliano.org.ar/multimedia/archivos/servicios_attachs/8717.pdf (consultado 2/09/2017).
-
Muñoz SA, Gandino IJ, Basta MC, Orden AO. Causas de admisión hospitalaria y factores pronósticos en pacientes con vasculitis asociadas a anticuerpos anticitoplasma de neutrófilo. Rev Arg Reumatol 2014;25:8-14.
-
Di Benedetto N, López Mujica MJ, Fernández ME, Tourón M, Muñoz SA, Allievi A. Características generales de 29 pacientes con vasculitis de pequeños vasos. Medicina (B Aires) 2010;70:127-32.
-
Pérez N, Gargiulo MA, Suárez L, Khoury M, Gómez G. Clinical characteristics and prognostic factors in an Argentinian cohort with ANCA-Associated Vasculitis. Medicina (B Aires) 2021;81:198-207.
-
Vargas D, Goecke A, Gatica H, Castro Lara A, Wurmann P. Comportamiento clínico y factores asociados a mortalidad temprana en una cohorte de pacientes chilenos con vasculitis asociadas a anticuerpos anticitoplasma de neutrófilos (VAA). Rev Med Chile 2020;148:755-61.
-
Dagostin MA, Nunes SLO, Shinjo SK, Pereira RMR. Mortality predictors in ANCA-associated vasculitis. Experience of a Brazilian monocentric cohort of a rheumatology center. Medicine 2021;100:51(e28305).
-
Flores-Suárez LF, Alba MA. Vasculitis asociadas a anticuerpos anticitoplasma de neutrófilos (ANCA) en un centro de tercer nivel de enfermedad respiratoria (1982-2010). Gac Med Mex 2015;151:176-85.
-
Pimentel-Quiroz VR, Sattui SE, Ugarte-Gil MF, Alarcón GS. ANCA-Associated Vasculitis in Latin America: A Systematic Literature Review: About Their Epidemiology and Their Clinical Features. J Clin Rheumatol 2022;28(1):44-51.
-
Lyons PA, Rayner TF, Trivedi S, et al. Genetically distinct subsets within ANCA-Associated Vasculitis. N Engl J Med 2012;367:214-23.
-
Cid MC. The search for genetic links in ANCA-associated vasculitis and its variants. N Engl J Med 2012;367:271-3.
-
Chung SA, Langford CA, Maz M, el al. American College of Rheumatology/Vasculitis Foundation Guideline for the Management of Antineutrophil Cytoplasmic Antibody–Associated Vasculitis. Arthritis Rheumatol 2021;73(8):1366-83.
-
De All J, Koutnouyan G, Herrando S, Diez E, Olmedo G, Gnocchi C. Otomastoiditis como manifestación clínica inicial de granulomatosis de Wegener. Medicina (B Aires) 2011;71(1):42-4. 31. Risso JA, Mazzocchi O, De All J, Gnocchi CA. Síndrome riñón-pulmón. Medicina (B Aires) 2009;69(6):663-73.
-
Massa M, Emery NC, Bosio M, Finn BC, Bruetman JE, Young P. Estenosis traqueal subglótica en enfermedad de Wegener. Reporte de dos casos. Rev Med Chil 2014;142(3):382-5.
-
Young P, Finn BC, Ceballos ME, Iturraspe M, Forrester M. Masas múltiples como presentación de enfermedad de Wegener. Nefrología 2009;29(4):376-7.
-
Young P, Finn BC, Fleire GJ, Earsman G, Bruetman JE. Claudicación mandibular, ¿pensar en enfermedad de Wegener? Nefrología 2009;29(3):278-9.
-
Nagiah S, Saranapala DMM. Severe proximal muscle weakness with normal CK as a presenting feature of ANCA-associated vasculitis. BMJ Case Rep 2020;13:e232854.
-
Lee YM, Chung SW. Granulomatosis with Polyangiitis Restricted to the Back Muscle: The First Case Report. Medicina 2020;56:431.
-
Jang Khan AJ, Jang Khan NA. Renal limited ANCA-positive vasculitis: a rare manifestation of a rare disease. J Investig Med High Impact Case Rep 2020;8:1-4.
-
Quadrelli S, Dubinsky D, Solis M, et al. Immune diffuse alveolar hemorrhage: Clinical presentation and outcome. Respiratory Medicine 2017;129:59e62.
-
Jennette JC, Falk RJ. Small-vessel vasculitis. N Engl J Med 1997;337:1512-23.
-
Hoffman GS, Kerr GS, Leavitt RY, et al. Wegener granulomatosis: an analysis of 158 patients. Ann Intern Med 1992;16:488-98.
-
Fauci AS, Haynes BF, Katz P, Wolff SM. Wegener’s granulomatosis: prospective clinical and therapeutic experience with 85 patients for 21 years. Ann Intern Med 1983;98:76-85.
-
Guillevin L, Durand-Gaasselin B, Cevallos R, et al. Microscopic polyangiitis. Clinical and laboratory findings in eighty-five patients. Arthritis Rheum 1999;42:421-30.
-
Falk RJ, Nachman PH, Hogan SL, Jennette JC. ANCA glomerulonephritis and vasculitis: a Chapel Hill perspective. Semin Nephrol 2000;20:233-43.
-
Hruskova Z, Tesar V, Geetha D. Renal Transplantation in Antineutrophil Cytoplasmic Antibody-Associated Vasculitis: Current Perspectives. Kidney Blood Press Res 2020;45:157-65.
-
Masset C, Kandel-Aznar C, Dantal J, et al. Early and late ANCA vasculitis relapses after kidney transplantation may have different presentations. Clinical Kidney Journal 2022;15:1021-3.
-
Sergent JS. Vasculitis Associated with Antineutrophil Cytoplasmic Antibody. En: Kelley´s textbook of Rheumatology, Sixth Edition; Philadelphia: W. B. Saunders Company. 2001; vol. 2: 1165- 84.
-
Cordier JF, Cottin V. Alveolar hemorrage in vasculitis: primary and secondary. Semin Respir Crit Care Med 2011;32:310-21.
-
de Groot K, Harper L, Jayne DR, et al. Pulse versus daily oral cyclophosphamide for induction of remission in antineutrophil cytoplasmic antibody-associated vasculitis: a randomized trial. Ann Intern Med 2009;150:670-80.
-
Adu D, Pall A, Luqmani RA, et al. Controlled trial of pulse versus continuous prednisolone and cyclophosphamide in the treatment of systemic vasculitis. QJM 1997;90:401-9.
-
Koike H, Nishi R, Ohyama K, et al. ANCA-Associated Vasculitic Neuropathies: A Review. Neurol Ther 2022;11:21-38.
-
Robson JC, Grayson PC, Ponte C, et al. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology classification criteria for granulomatosis with polyangiitis. Ann Rheum Dis 2022;81(3):315-20.
-
Suppiah R, Robson JC, Grayson PC, et al. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology classification criteria for microscopic polyangiitis. Ann Rheum Dis 2022;81(3):321-6.
-
Grayson PC, Ponte C, Suppiah R, et al. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology Classification Criteria for Eosinophilic Granulomatosis with Polyangiitis. Ann Rheum Dis 2022;81(3):309-14.
-
Monach PA, Warner RL, Lew R. Serum Biomarkers of Disease Activity in Longitudinal Assessment of Patients with ANCA-Associated Vasculitis. ACR Open Rheumatology 2022;4:168-76.
-
Kang EH, Ha YJ, Lee YJ. Autoantibody Biomarkers in Rheumatic Diseases. Int J Mol Sci 2020;21:1382.
-
Maruyama H, Hirayama K, Yamashita M, et al. Serum 20S proteasome levels are associated with disease activity in MPO ANCA-associated microscopic polyangiitis. BMC Rheumatology 2020;4:36.
-
Villacorta J, Lucientes L, Goicoechea E, et al. Urinary soluble CD163 as a biomarker of disease activity and relapse in antineutrophil cytoplasm antibody-associated glomerulonephritis. Clinical Kidney Journal 2021;14:212-9.
-
Rowaiye OO, Kusztal M, Zabinska M, et al. Anti-ETAR and suPAR as markers of disease activity in renal ANCA-associated vasculitis. Adv Med Sci 2022;67(1):23-8.
-
Wang R, An D, Wu Y, Ma P, Guo Y, Tang L. Clinicopathological characteristics and outcomes of anti‑neutrophil cytoplasmic autoantibody‑related renal vasculitis with hyperuricemia: a retrospective case‑control study. Scientific Reports 2021;11:2002.
-
Chalkia A, Thomas K, Giannou P, et al. Hypocomplementemia is associated with more severe renal disease and worse renal outcomes in patients with ANCA-associated vasculitis: a retrospective cohort study. Renal Failure 2020;42:845-52.
-
Fuchs S, Scheffschick A, Gunnarsson I, Brauner H. Natural Killer Cells in Anti-Neutrophil Cytoplasmic Antibody-Associated Vasculitis - A Review of the Literature. Front Immunol 2022;12:796640.
-
Jonasdottir AD, Antovic A, Qureshi AR, et al. Pentraxin-3 – a potential biomarker in ANCA-associated vasculitis. Scand J Rheumatol 2022;00:1-9.
-
Pyo JY, Ahn S, Lee LE, Song JJ, Park YB, Lee SW. New body mass index for predicting prognosis in patients with antineutrophil cytoplasmic antibody-associated vasculitis. J Clin Lab Anal 2022;36:e24357.
-
Park PG, Song JJ, Park YB, Lee SW. Clinical application of low erythrocyte sedimentation rate/high C-reactive protein to antineutrophil cytoplasmic antibody-associated vasculitis. J Clin Lab Anal 2022;36:e24237.
-
Villacorta J, Martinez-Valenzuela L, Capon IM, Bordignon-Draibe J. Antineutrophil Cytoplasmic Antibody-Associated Vasculitis: Toward an Individualized Approach. Nephron 2022;146:121-37.
-
Arzoun H, Srinivasan M, Raja Thangaraj S, et al. Recent Advancements in the Management of Anti-neutrophil Cytoplasmic Antibody-Associated Vasculitis: A Systematic Review. Cureus 2022;14(2):e21814.
-
Austin K, Janagan S, Wells M, Crawshaw H, McAdoo S, Robson JC. ANCA Associated Vasculitis Subtypes: Recent Insights and Future Perspectives. Journal of Inflammation Research 2022;15:2567-82.
-
Chung, S.-W. Vasculitis: From Target Molecules to Novel Therapeutic Approaches. Biomedicines 2021;9:757.
-
Carranza‑Enríquez F, Meade‑Aguilar JA, Hinojosa‑Azaola A. Rituximab treatment in ANCA‑associated vasculitis patients: outcomes of a real‑life experience from an observational cohort. Clin Rheumatol 2022;41(9):2809-16.
-
Smith RM, Jones RB, Specks U, et al. Rituximab as therapy to induce remission after relapse in ANCA-associated vasculitis. Ann Rheum Dis 2020;79:1243-49.
-
Xiao Y, Guyatt G, Zeng L, et al. Comparative efficacy and safety of alternative glucocorticoids regimens in patients with ANCA-associated vasculitis: a systematic review. BMJ Open 2022;12:e050507.
-
Floyd L, Morris A, Joshi M, Dhaygude A. Glucocorticoid Therapy in ANCA Vasculitis: Using the Glucocorticoid Toxicity Index as an Outcome Measure. Kidney 2021;2:1002-10.
-
Pepper RJ, McAdoo SP, Moran SM, et al. A novel glucocorticoid-free maintenance regimen for anti-neutrophil cytoplasm antibody-associated vasculitis. Rheumatology (Oxford) 2019;58:260-8.
-
Jayne DR, Gaskin G, Rasmussen N, et al. Randomized trial of plasma exchange or high-dosage methylprednisolone as adjunctive therapy for severe renal vasculitis. J Am Soc Nephrol 2007;18:2180-8.
-
Walsh M, Merkel PA, Peh CA, et al. Plasma Exchange and Glucocorticoids in Severe ANCA-Associated Vasculitis. N Engl J Med 2020;382(7):622-31.
-
Tsiakas S, Marinaki S, Lionaki S, Boletis J. Plasma Exchange in ANCA-Associated Vasculitis: A Narrative Review. J Clin Med 2021;10:51-4.
-
Zeng L, Walsh M, Guyatt GH, et al. Plasma exchange and glucocorticoid dosing for patients with ANCA-associated vasculitis: a clinical practice guideline. BMJ 2022;376:e064597.
-
Walsh M, Collister D, Zeng L, et al. The effects of plasma exchange in patients with ANCA-Associated vasculitis: an updated systematic review and meta-analysis. BMJ 2022;376:e064604.
-
Amudala NA, Boukhlal S, Sheridan B, et al. Obinutuzumab as Treatment for ANCA-Associated Vasculitis. Rheumatology (Oxford) 2021:keab916.
-
Jayne DRW, Bruchfeld AN, Harper L, et al. Randomized trial of C5a receptor inhibitor Avacopan in ANCA-associated vasculitis. J Am Soc Nephrol 2017;28:2756-67.
-
Jayne DRW, Merkel PA, Schall TJ, Bekker P. Avacopan for the treatment of ANCA-associated vasculitis. N Engl J Med 2021;384:599-609.
-
Gabilan C, Pfirmann P, Ribes D, et al. Avacopan as First-Line Treatment in Antineutrophil Cytoplasmic Antibody-Associated Vasculitis: A Steroid-Sparing Option. Kidney Int Rep 2022;7:1115-8.
-
Massicotte-Azarniouch D, Petrcich W, Walsh M, et al. Association of anti-neutrophil cytoplasmic antibody-associated vasculitis and cardiovascular events: a population-based cohort study. Clinical Kidney Journal 2022;15:681-92.
Pablo Young
Servicio de ClÃnica Médica. Equipo de respuesta rápida en vasculitis.
Nicolás MarÃn Zúcaro
Servicio de ClÃnica Médica.
AgustÃn Montes OnganÃa
Servicio de ClÃnica Médica.
Franco Giuliani Manzano
Servicio de ClÃnica Médica.
MarÃa Victoria Faura
Servicio de ClÃnica Médica.
MarÃa Agustina Bustos
Servicio de ClÃnica Médica.
Amalia Schiel
Servicio de Laboratorio.
Alexis Muryan
Servicio de Laboratorio.
Débora Pellegrini
Servicio de ClÃnica Médica.
Geoffrey Earsman
Servicio de ClÃnica Médica. Servicio de ReumatologÃa. Equipo de respuesta rápida en vasculitis.
Hugo A Laborde
Servicio de ReumatologÃa. Equipo de respuesta rápida en vasculitis.
Bárbara C Finn
Servicio de ClÃnica Médica.
Julio E Bruetman
Servicio de ClÃnica Médica.
Hernán Trimarchi
Servicio de NefrologÃa. quipo de respuesta rápida en vasculitis.
Alejandro Iotti
Servicio de AnatomÃa Patológica. quipo de respuesta rápida en vasculitis.
MartÃn Bosio
Servicio de NeumonologÃa. quipo de respuesta rápida en vasculitis.
Damián Duartes Noe
Servicio de ReumatologÃa. Equipo de respuesta rápida en vasculitis. Hospital Británico de Buenos Aires, Argentina.
Autor correspondencia
Pablo Young
Servicio de ClÃnica Médica. Equipo de respuesta rápida en vasculitis.
Correo electrónico: pabloyoung2003@yahoo.com.ar
Para descargar el PDF del artículo
Vasculitis asociadas a ANCA: análisis de 26 pacientes
![]() Haga click aquí
Haga click aquí
Para descargar el PDF de la revista completa
Revista Fronteras en Medicina, Volumen Año 2022 Num 03
Revista Fronteras en Medicina
Número 03 | Volumen
17 | Año 2022
Su Majestad la Reina Isabel II y nu...
Juan DC Emery
Conocer la realidad: sobre mundiale...
Belén MarÃa Virasoro
Vasculitis asociadas a ANCA: an�...
Pablo Young y cols.
Frecuencia de debilidad adquirida e...
Facundo Bianchini y cols.
Estudio descriptivo de las caracter...
Jorgelina Real y cols.
Estudio retrospectivo para describi...
Rosario D´Hers y cols.
Nivel de conocimiento acerca de mÃ...
Natalia Soledad Rizzo y cols.
La lipohipertrofia como complicaci�...
Sandra Peña y cols.
Programa de calidad y seguridad del...
Dora Maciel y cols.
Importancia del abordaje terapéu...
Mario Schiter RodrÃguez
La graduación de EnfermerÃa d...
Teresa Gómez
Sospecha de granulomatosis linfomat...
Josefina Pascua y cols.
Atención compasiva
Hugo Eduardo Abuin
Etiquetas
vasculitis asociadas a ANCA, granulomatosis con poliangeÃtis, poliangeÃtis microscópica, vasculitis limitada al riñón, granulomatosis eosinofÃlica con poliangeÃtis
Tags
ANCA-associated vasculitis, granulomatosis with polyangiitis, microscopic polyangiitis, vasculitis limited to the kidney, eosinophilic granulomatosis with polyangiitis
Vasculitis asociadas a ANCA: análisis de 26 pacientes
Autores
Pablo Young, Nicolás MarÃn Zúcaro, AgustÃn Montes OnganÃa, Franco Giuliani Manzano, MarÃa Victoria Faura, MarÃa Agustina Bustos, Amalia Schiel, Alexis Muryan, Débora Pellegrini, Geoffrey Earsman, Hugo A Laborde, Bárbara C Finn, Julio E Bruetman, Hernán Trimarchi, Alejandro Iotti, MartÃn Bosio, Damián Duartes Noe
Publicación
Revista Fronteras en Medicina
Editor
Hospital Británico de Buenos Aires
Fecha de publicación
2022-09-30
Registro de propiedad intelectual
© Hospital Británico de Buenos Aires